A RDC 982/2025 institui um novo modelo de gestão de risco sanitário e monitoramento contínuo da conformidade como base para conceder, renovar ou cancelar o Certificado de Boas Práticas de Fabricação (CBPF) e o Certificado de Boas Práticas de Distribuição e/ou Armazenagem (CBPDA).
Essa norma define 17 critérios objetivos para avaliação e amplia mecanismos de supervisão que podem levar a inspeções, investigações e cancelamento de certificados quando houver riscos substanciais à saúde pública.

O que é a RDC 982/2025 e por que ela importa para sua empresa?
A RDC 982/2025 representa uma mudança de paradigma na forma como a Anvisa avalia estabelecimentos. Com ela, a agência muda de um modelo puramente documental e episódico para um modelo continuado, baseado em risco e evidências. A Resolução da Diretoria Colegiada também regula a aplicação retroativa em processos que ainda não tenham decisão publicada no Diário Oficial, o que torna essencial a revisão de petições em andamento.
Isso afeta companhias querem contar com os Certificados de Boas Práticas de Fabricação (CBPF) e de Distribuição e/ou Armazenagem (CBPDA). As mais impactadas são as empresas que atuam com:
- atividades de fabricação;
- distribuição e armazenamento de insumos farmacêuticos ativos (IFA);
- medicamentos;
- produtos de Cannabis para fins medicinais;
- produtos biológicos;
- dispositivos médicos.
Para executivos e gestores isso significa que a certificação deixará de ser apenas um “selo” renovado periodicamente. Essa mudança faz com que ela passe a ser um processo dinâmico cujo resultado depende tanto do histórico de conformidade quanto do comportamento contínuo da operação da companhia.
Em termos práticos, empresas com controles frágeis passarão a enfrentar maior probabilidade de escrutínio. Por outro lado, organizações com governança robusta e monitoramento em tempo real ganham previsibilidade e vantagem competitiva com essa mudança.
Os 17 critérios para a gestão de risco sanitário aplicada à concessão ou renovação do CBPF ou do CBPD/A de acordo com a nova RDC 982/2025, são:
- Classe e classificação de risco do produto;
- Complexidade e criticidade do estabelecimento;
- Condições de armazenagem e transporte do insumo e/ou produto acabado;
- Histórico de conformidade e regularidade da empresa e de seus produtos;
- Histórico de cumprimento de Boas Práticas de Fabricação (BPF) e de Distribuição/Armazenagem pelo estabelecimento;
- Linha de fabricação, etapa do processo e forma farmacêutica a ser certificada;
- Monitoramento pós-mercado dos produtos;
- Tempo decorrido desde a última inspeção;
- Relatórios de inspeção ou CBPF emitidos por Autoridade Reguladora Estrangeira Equivalente (AREE);
- Relatórios de inspeção ou CBPF emitidos por autoridades reguladoras ou membros do PIC/S;
- Relatórios de inspeção emitidos por autoridades sanitárias de países do IMDRF
- Relatórios de auditoria no âmbito do MDSAP;
- Resultados de análises laboratoriais, fiscais ou de controle;
- Contexto epidemiológico e sanitário nacional e internacional;
- Controle por meio de inspeção aleatória;
- Risco de descontinuação de produtos sujeitos à vigilância sanitária no mercado
- Relatórios de inspeção emitidos pela Anvisa ou órgãos de Vigilância Sanitária estaduais, distrital ou municipais.
Quais são as principais mudanças da RDC 982/2025?
1. Gestão de risco sanitário como critério central
A norma formaliza o uso de critérios de gestão de risco sanitário para avaliação de concessão e renovação de CBPF/CBPDA. Ou seja, a Anvisa combinará informações técnicas e indicadores de risco para decidir se uma empresa terá a certificação ou não. Isso torna necessário que as corporações identifiquem, mensurem e evidenciem seus riscos sanitários continuamente, não apenas no momento de auditorias pontuais.
2. Lista de critérios
O texto da RDC especifica um conjunto de critérios que devem ser avaliados de forma combinada para estipular o risco sanitário do estabelecimento. Esses critérios agregam elementos operacionais, históricos de não conformidade, natureza dos produtos, complexidade dos processos, fatores externos, entre outros.
3. Monitoramento contínuo e mecanismos de atuação
Além da avaliação inicial, a Anvisa passa a praticar monitoramento contínuo da conformidade. Isso significa que alertas, relatórios, notificações de eventos adversos, investigações e inspeções podem ser acionados ao longo do período de validade do certificado. Além disso, a RDC 982/2025 também possibilita o cancelamento do certificado caso o parecer técnico aponte a alguma conformidade grave.
4. Reconhecimento de autoridades estrangeiras e práticas de confiança regulatória
A resolução prevê, quando aplicável, o uso de informações provenientes de Autoridades Reguladoras Estrangeiras Equivalentes (AREE) como insumo para avaliação. Essa mudança permite acelerar processos quando há confiança regulatória mútua; entretanto, ao mesmo tempo exige que as empresas saibam qual documentação e histórico internacional podem ser considerados pela Anvisa.
5. Regulamentação no uso de IA para a gestão de risco sanitário
A RDC 982/2025 tem relação direta com a Inteligência Artificial (IA). No Capítulo II, Art. 3º, § 3º, a Anvisa estabelece que modelos de IA podem ser utilizados no processo de gestão de risco sanitário para concessão ou renovação do CBPF e do CBPDA.
No entanto, o uso de IA não é irrestrito. A norma determina que qualquer modelo adotado deve:
- Garantir consistência técnica na análise;
- Proteger dados sensíveis, cumprindo a LGPD;
- Assegurar rastreabilidade das informações e decisões geradas;
- Passar por validação da Anvisa antes de entrar em uso oficial.
Na prática, isso significa que a IA pode apoiar a avaliação integrada dos 17 critérios de risco listados na resolução, ajudando a identificar padrões, prever não conformidades e otimizar o processo de inspeção. Mas a responsabilidade final e a supervisão permanecem com a Anvisa, evitando que decisões críticas sejam tomadas sem controle humano.
Alguns dos exemplos do uso de IA na gestão de risco sanitário em conformidade com a RDC são:
- Análise preditiva de risco baseado no histórico de conformidade – A IA pode cruzar dados internos da empresa (auditorias passadas, não conformidades, desvios de produção, entre outros) com dados externos de autoridades sanitárias para prever a probabilidade de reprovação em futuras inspeções. Isso atende permite realizar ações corretivas antecipadas para que não conformidades que ocorreram no passado não venham a se repetir.
- Monitoramento automatizado de condições de armazenagem e transporte – Sensores com Internet das Coisas (IoT em inglês) podem coletar dados de temperatura, umidade e vibração em tempo real, e modelos de IA analisam desvios e tendências nessas informações. Ao identificar padrões que antecedem não conformidades, a empresa pode agir antes que haja impacto no produto/serviço.
- Correlação de dados de mercado com contexto epidemiológico – A Inteligência Artificial pode integrar alertas internacionais e dados locais de surtos ou recalls para ajustar os planos de produção e inspeção, e assim ajuda a priorizar lotes críticos e reforçar a rastreabilidade.
- Classificação inteligente de risco por produto e linha de fabricação – Modelos de machine learning podem classificar e ranquear produtos, processos e plantas industriais com base em criticidade, forma farmacêutica e complexidade do estabelecimento. Assim, a equipe de qualidade consegue focar recursos e esforços de inspeção nas áreas mais sensíveis.

Quais são os impactos práticos dessa Resolução da Diretoria Colegiada?
Como você pode imaginar, a RDC 982/2025 reflete em diversas mudanças e adaptações para as empresas que desejam manter/conquistar seus certificados, ou apenas garantir uma operação em conformidade com as melhores práticas sanitárias do mercado.
Os principais impactos da resolução podem ser divididos em três categorias: operacional, financeiro e reputacional & negócios. Saiba mais sobre cada um deles abaixo!
Impacto operacional
- Continuidade de controles: Com a implementação da Resolução da Diretoria Colegiada 982/2025, as empresas de indicadores em tempo real (ou com cadência frequente) que mostrem performance de produção, desvios, não conformidades e eficácia de CAPAs.
- Integração entre áreas: Os setores de Regulação, Qualidade, Supply Chain e TI passam a trabalhar de forma integrada para demonstrar controle end-to-end da conformidade com a resolução.
Impacto financeiro
- Custos de adequação: É necessário incrementar os investimentos em sistemas de gestão da qualidade. Contar com soluções de automação, auditorias internas e capacitação podem ser necessários.
- Risco de perda de receita: Em caso de não conformidade, o cancelamento de certificado ou a necessidade de exigências corretivas que interrompam operações podem acarretar perdas diretas e custos de remediação.
- Benefício de mercado: Por outro lado, as empresas com evidência de governança e compliance contínuo tendem a reduzir tempo em processos regulatórios futuros e, potencialmente, ganhar acesso a mercados que valorizam essa conformidade.
Impacto reputacional e de negócios
- Exposição ao mercado: As eventuais medidas punitivas (como investigações ou a suspensão de certificados) indicadas pela RDC 982/2025 em caso de não conformidade têm impacto direto sobre a confiança de parceiros, clientes e investidores.
- Diferenciação competitiva: Operar com métricas transparentes de conformidade pode ser vantagem em contratos com stakeholders exigentes em relação à segurança sanitária, assim como diversos players no mercado internacional.

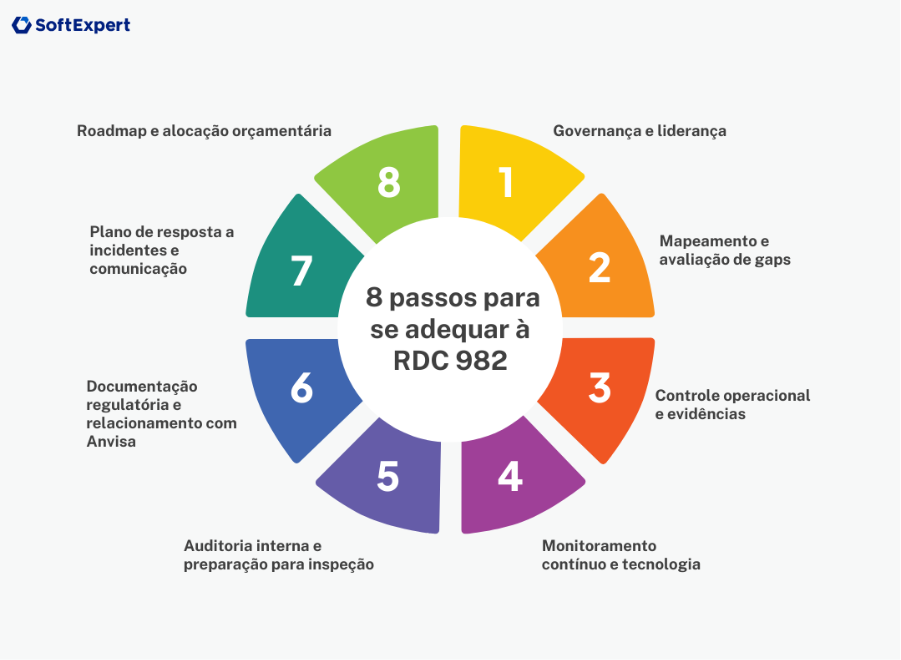
8 passos para sua empresa se adequar à nova RDC
Para evitar que os impactos negativos da Resolução da Diretoria Colegiada 982/2025 acabem afetando a sua empresa, é fundamental saber como adaptar a sua operação e garantir a conformidade com os principais requisitos da RDC. Isso significa revisar políticas internas, estipular controles contínuos, implementar mudanças de forma estruturada e muito mais.
Visando facilitar essa adaptação, preparamos um breve checklist que se adequa à maioria dos perfis de empresas afetadas pela nova resolução. Mas lembre-se: esse é apenas uma estrutura padrão; adapte tudo para a realidade da sua companhia e utilize as informações como um ponto de partida.
1. Governança e liderança
- Nomeie um responsável principal pelo projeto de adequação à RDC. Essa pessoa deve ter autoridade para direcionar recursos (financeiros, de tempo, pessoal, entre outros.
- Crie um comitê multidisciplinar (que envolva setores como Regulação, Qualidade, Supply Chain, TI, Jurídico, entre outros) e organize reuniões periódicas para acompanhar os KPIs relacionados ao projeto – que serão definidos mais adiante nesse checklist.
2. Mapeamento e avaliação de gaps
- Execute uma gap analysis levando em conta os 17 critérios mencionados na RDC. Nesse momento, busque mapear a presença ou ausência de controles, evidências documentais, indicadores, riscos residuais e demais critérios.
- Depois, priorize a ordem de resolução dos gaps encontrados utilizando como principal critério o impacto de cada um na conformidade com a RDC. Classifique esse impacto levando em conta o nível de risco (alto, médio, baixo) versus a facilidade de mitigação de cada um.
3. Controle operacional e evidências
- Consolide todas as evidências encontradas nos processos anteriores. Elas podem ser procedimentos, registros de produção, relatórios de calibração, rastreabilidade, relatórios de desvios e CAPAs.
- Implemente indicadores-chave (KPIs) que servirão como base de avaliação do projeto de adequação à RDC. Por exemplo, você pode usar a frequência de desvios críticos por lote, o tempo médio de fechamento de CAPA, a temperatura média de armazenamento, o nível de conformidade, entre outros.
4. Monitoramento contínuo e tecnologia
- Adote um sistema de QMS digital que permita coletar e consultar evidências em tempo real. Além disso, priorize aquelas soluções que contam com integrações com sistemas de manufatura e armazenagem (MES, WMS) ou que já possuem essas ferramentas dentre seus recursos.
- Implemente dashboards que mostrem o nível de conformidade e alertas automáticos para níveis críticos de não conformidade.
5. Auditoria interna e preparação para inspeção
- Planeje um ciclo de auditorias internas com foco nos 17 critérios, usando checklists padronizados e demais ferramentas que aumentam as chances de sucesso em uma auditoria.
- Simule inspeções e revise respostas e evidências encontradas nessa simulação.
6. Documentação regulatória e relacionamento com Anvisa
- Revise petições e dossiês em andamento para verificar o impacto da norma na sua empresa, especialmente nos processos sem decisão publicada no Diário Oficial da União (DOU).
- Estabeleça um fluxo de comunicação com a área técnica/regulatória para envio de evidências proativas quando solicitado.
7. Plano de resposta a incidentes e comunicação
- Defina um playbook de resposta para essas ocasiões. Lembre-se de incluir ações voltadas para investigação, mitigação, relatório interno e comunicação externa (com clientes e autoridades de saúde, quando necessário).
- Treine as equipes para garantir um tempo de resposta ágil e a qualidade das evidências.
8. Roadmap e alocação orçamentária
- Monte uma linha do tempo para o planejamento e execução de todas as atividades anteriores. Crie também marcos/prazos claros para cada uma, como, por exemplo, o que será feito de 0 a 3 meses; depois de 3 a 9 meses; e por fim de 9 a18 meses. Inclua também quem serão as pessoas responsáveis por cada uma dessas etapas.
- Faça o orçamento de todas as iniciativas críticas, incluindo o investimento em ferramentas, sistemas, consultoria regulatória, capacitação etc.
Links relacionados:
A solução ideal para as empresas adaptadas pela RDC 982/2025
Se adaptar à nova RDC e ter uma estrutura definida para analisar lacunas, planejar ações e adaptar sua operação não é o suficiente para facilitar a conformidade com a nova RDC. As empresas que desejam tornar esse processo mais ágil, seguro e automatizado precisam ir além: contar com um sistema de gestão de conformidade e qualidade como o SoftExpert Suite.
Com esse sistema, você pode executar uma série de tarefas que ajudam sua empresa a ter compliance com a normativa da Anvisa. Dentre elas, estão o monitoramento contínuo de conformidade, a rastreabilidade total de processos, IA integrada e validada pelos padrões da Anvisa, automação de gestão de mudanças e não conformidades, a análise preditiva dos riscos e muito mais.
Descubra mais sobre como o SoftExpert Suite já possui funcionalidades preparadas para a RDC 982/2025.
Monitoramento contínuo da conformidade com a Resolução da Diretoria Colegiada
O SoftExpert QMS automatiza e integra os processos essenciais da gestão de qualidade, como planejamento, auditorias, controle de qualidade, não conformidades, documentos, fornecedores, riscos e indicadores. Isso reduz retrabalhos, aumenta a padronização e fortaleça a conformidade.
Assim, o sistema pode identificar tendências de não conformidade antes que elas se tornem problemas para a sua empresa. Além disso, você conta com alertas e dashboards em tempo real para agilizar tomada de decisões estratégicas, mitigando impactos negativos.
Foi assim que a empresa Pharlab automatizou a gestão de treinamentos e documentos, reduzindo em 48% os custos com a gestão da qualidade.
Preparação automática para auditorias da RDC
Com a funcionalidade de Audit, você pode gerenciar suas auditorias desde o planejamento até a preparação e a execução, definindo cronogramas, desenvolvendo planos e emitindo relatórios de forma eficiente.
Isso permite organizar automaticamente as evidências de acordo com cada critério da RDC 982/2025, assim como gerar relatórios estruturados para os auditores da Anvisa – e tudo isso com total rastreabilidade de cada etapa do processo de auditoria.
Gestão inteligente de mudanças
Uma série de recursos atuam de forma integrada para garantir uma gestão inteligente e automatizada das diversas mudanças (e controles de tais mudanças) que a nova RDC pode gerar na operação da sua companhia.
Combinando ferramentas como Workflow, Document e Training é possível:
- Gerar fluxos automatizados que garantem a aprovação/revisão adequada de documentos;
- Compartilhar esses documentos com diversas áreas/pessoas e gerenciar o acesso a eles;
- Disponibilizar automaticamente todos os treinamentos obrigatórios relacionados à RDC 982.
Dessa forma, a farmacêutica União Química conseguiu digitalizar mais de três mil documentos críticos, o que gerou 30% de aumento na produtividade graças acesso instantâneo às informações desses documentos.
Análise preditiva de riscos
Utilizando o Copilot AI e a funcionalidade de Risk, você usa o poder de análise da inteligência artificial com a capacidade de documentar, simular e remediar riscos de conformidade.
O Copilot IA identifica padrões que podem causar não conformidades e, além disso, oferece recomendações automáticas de ações preventivas e corretivas. Utilizando a ferramenta de Risk, você pode simular diferentes cenários e, assim, tomar a decisão mais acertada para lidar com essas ameaças.

Conclusão
A RDC 982/2025 representa um marco na forma como a Anvisa conduz a gestão de risco sanitário, trazendo mais rigor técnico, transparência e previsibilidade ao processo de concessão e renovação de certificações. Ao alinhar critérios de avaliação com práticas internacionais e incorporar recursos tecnológicos, a resolução reforça a necessidade de que empresas adotem sistemas de gestão de conformidade robustos e capazes de responder rapidamente a exigências regulatórias cada vez mais dinâmicas.
Para os fabricantes, importadores e distribuidores de IFAs, medicamentos, produtos biológicos, dispositivos médicos e derivados de Cannabis medicinal, o cumprimento desses requisitos vai além da conformidade legal. A nova norma é um mecanismo para manter competitividade, proteger a reputação e assegurar a continuidade dos negócios em um mercado altamente regulado. Por isso, antecipar-se às mudanças e investir em processos de melhoria contínua será fundamental para transformar as obrigações da RDC 982/2025 em vantagem estratégica.
Se sua organização opera com esses produtos, este é o momento para:
- Iniciar um gap analysis focado nos 17 critérios da resolução;
- Priorizar a implantação de monitoramento contínuo com indicadores acionáveis;
- Envolver a liderança sênior para garantir os recursos e a governança necessários.
Buscando mais eficiência e conformidade em suas operações? Nossos especialistas podem ajudar a identificar as melhores estratégias para sua empresa com as soluções da SoftExpert. Fale com a gente hoje mesmo!
FAQ sobre a RDC 982/2025
Sim, a resolução entrou em vigor na data de sua publicação no Diário Oficial da União. Empresas devem considerar a norma para processos que ainda não tenham decisão publicada.
Como a RDC já está em vigor desde 29 de julho de 2025, a adequação deve ser imediata para novos processos.
Busque utilizar APIs robustas que permitem a integração com ERPs e sistemas legados sem interrupção.
IFAs, medicamentos, produtos de cannabis medicinal, produtos biológicos e dispositivos médicos estão explicitamente listados no escopo.
Distribuidores e armazenadores passam a ser avaliados pelo mesmo arcabouço de gestão de risco. Além disso, as evidências de controle de qualidade e rastreabilidade ganham relevância para manutenção do CBPDA.
Sim, a norma prevê monitoramento contínuo e que um parecer técnico baseado em gestão de risco pode resultar em medidas administrativas, incluindo a suspensão ou cancelamento de certificados quando existirem riscos relevantes.
Algumas das evidências exigidas serão o histórico completo de conformidade, dados de monitoramento contínuo e análises de risco documentadas.
Por meio de um QMS integrado, KPIs de conformidade, auditorias internas regulares, registros eletrônicos auditáveis e capacidade de resposta rápida a desvios e investigações.
As certificações atuais permanecem válidas, mas são sujeitas ao monitoramento contínuo e possível cancelamento baseado na análise de risco.
Dentre os principais estão a perda de certificações, multas, interrupção de operações e a perda de competitividade.
Para saber isso, avalie se a sua ferramenta de IA atende aos padrões de consistência, proteção de dados, rastreabilidade e validação técnica exigidos pela Anvisa.