Le RDC 982/2025 institue un nouveau modèle de gestion des risques sanitaires et de contrôle continu de la conformité comme base pour l’octroi, le renouvellement ou l’annulation du Certificat de Bonnes Pratiques de Fabrication (CBPF) et du Certificat de Bonnes Pratiques de Distribution et/ou de Stockage (CBPDA).
Cette norme définit 17 critères objectifs d’évaluation et élargit les mécanismes de surveillance qui peuvent mener à des inspections, des enquêtes et l’annulation de certificats lorsqu’il existe des risques substantiels pour la santé publique.

Qu’est-ce que la norme RDC 982/2025 et pourquoi est-elle importante pour votre entreprise ?
La RDC 982/2025 représente un changement de paradigme dans la manière dont l’Anvisa évalue les établissements. Avec lui, l’agence passe d’un modèle purement documentaire et épisodique à un modèle continu, basé sur le risque et les preuves. La résolution du Conseil collégial réglemente également l’application rétroactive dans les cas qui n’ont pas encore fait l’objet d’une décision publiée au Journal officiel, ce qui rend essentiel l’examen des pétitions en cours.
Cela concerne les entreprises qui souhaitent disposer des Certificats de Bonnes Pratiques de Fabrication (CBPF) et de Distribution et/ou de Stockage (CBPDA). Les entreprises les plus touchées sont celles qui travaillent avec :
- activités manufacturières ;
- la distribution et l’entreposage d’ingrédients pharmaceutiques actifs (API) ;
- Drogues;
- Produits du cannabis à des fins médicinales ;
- produits biologiques ;
- dispositifs médicaux.
Pour les dirigeants et les managers, cela signifie que la certification ne sera plus seulement un « sceau » renouvelé périodiquement. Ce changement en fait un processus dynamique dont l’issue dépend à la fois de l’historique de conformité et du comportement continu du fonctionnement de l’entreprise.
En termes pratiques, les entreprises dont les contrôles sont faibles seront plus susceptibles d’être surveillées. D’autre part, les organisations dotées d’ une gouvernance solide et d’une surveillance en temps réel bénéficient de la prévisibilité et d’un avantage concurrentiel grâce à ce changement.
Les 17 critères de gestion des risques sanitaires appliqués à l’octroi ou au renouvellement du CBPF ou du CBPD/A selon le nouveau RDC 982/2025 sont :
- Classe de produit et classification des risques ;
- Complexité et criticité de l’établissement ;
- les conditions d’entreposage et de transport de l’intrant et/ou du produit fini ;
- Historique de conformité et de régularité de l’entreprise et de ses produits ;
- Historique de conformité aux Bonnes Pratiques de Fabrication (BPF) et de Distribution/Entreposage par l’établissement ;
- Ligne de fabrication, étape du processus et forme pharmaceutique à certifier ;
- Suivi post-commercialisation des produits ;
- Temps écoulé depuis la dernière inspection ;
- Rapports d’inspection ou de BPF délivrés par une autorité réglementaire étrangère équivalente (AREE) ;
- Rapports d’inspection ou de BPF délivrés par les autorités réglementaires ou membres du PIC/S ;
- Rapports d’inspection émis par les autorités sanitaires des pays de l’IMDRF
- Rapports d’audit dans le cadre du MDSAP ;
- Résultats d’analyses de laboratoire, fiscales ou de contrôle ;
- Contexte épidémiologique et sanitaire national et international ;
- Contrôle par contrôle aléatoire ;
- Risque d’arrêt des produits faisant l’objet d’une surveillance sanitaire sur le marché
- Rapports d’inspection délivrés par l’Anvisa ou les agences de surveillance de la santé de l’État, du district ou de la municipalité.
Quelles sont les principales modifications apportées à la résolution RDC 982/2025 ?
1. La gestion des risques sanitaires comme critère central
La règle formalise l’utilisation de critères de gestion des risques sanitaires pour l’évaluation de la concession et le renouvellement du CBPF/CBPDA. En d’autres termes, l’Anvisa combinera des informations techniques et des indicateurs de risque pour décider si une entreprise sera certifiée ou non. Il est donc nécessaire pour les entreprises d’identifier, de mesurer et de prouver leurs risques pour la santé en permanence, et pas seulement lors d’audits ponctuels.
2. Liste des critères
Le texte de la CDR spécifie un ensemble de critères qui doivent être évalués de manière combinée pour stipuler le risque sanitaire de l’établissement. Ces critères ajoutent des éléments opérationnels, des antécédents de non-conformité, la nature des produits, la complexité des processus, des facteurs externes, entre autres.
3. Mécanismes de surveillance et d’action continus
En plus de l’évaluation initiale, Anvisa commence à pratiquer un contrôle continu de la conformité. Cela signifie que des alertes, des rapports, des notifications d’événements indésirables, des enquêtes et des inspections peuvent être déclenchés tout au long de la période de validité du certificat. En outre, le document RDC 982/2025 permet également l’annulation du certificat si l’avis technique fait état d’une conformité grave.
4. Reconnaissance des autorités étrangères et pratiques de confiance réglementaire
La résolution prévoit, le cas échéant, l ‘utilisation d’informations provenant d’autorités réglementaires étrangères équivalentes (AREE) comme données d’évaluation. Ce changement permet d’accélérer les processus lorsqu’il y a confiance réglementaire mutuelle ; cependant, en même temps, elle exige des entreprises qu’elles sachent quelle documentation et quelle histoire internationale peuvent être prises en compte par l’Anvisa.
5. Réglementation relative à l’utilisation de l’IA pour la gestion des risques sanitaires
Le document RDC 982/2025 est directement lié à l’intelligence artificielle (IA). Au chapitre II, article 3, paragraphe 3, l’Anvisa établit que les modèles d’IA peuvent être utilisés dans le processus de gestion des risques sanitaires pour l’octroi ou le renouvellement du CBPF et du CBPDA.
Cependant, l’utilisation de l’IA n’ est pas illimitée. La règle détermine que tout modèle adopté doit :
- Assurer la cohérence technique de l’analyse ;
- Protéger les données sensibles, en respectant la LGPD ;
- Assurer la traçabilité des informations et des décisions générées ;
- Subir la validation de l’Anvisa avant d’entrer dans l’utilisation officielle.
En pratique, cela signifie que l’IA peut prendre en charge l ‘évaluation intégrée des 17 critères de risque énumérés dans la résolution, en aidant à identifier les modèles, à prédire les non-conformités et à optimiser le processus d’inspection. Mais la responsabilité et la surveillance ultimes restent du ressort de l’Anvisa, ce qui empêche que des décisions cruciales ne soient prises sans contrôle humain.
Voici quelques exemples d’utilisation de l’IA dans la gestion des risques sanitaires dans le respect de la RDC :
- Analyse prédictive des risques basée sur l’historique de conformité – L’IA peut croiser les données internes de l’entreprise (audits passés, non-conformités, écarts de production, entre autres) avec des données externes des autorités sanitaires pour prédire la probabilité d’échec des inspections futures. Cela vous permet de prendre des actions correctives à l’avance afin que les non-conformités survenues dans le passé ne soient pas réduites au minimum.
- Surveillance automatisée des conditions de stockage et de transport – Les capteurs dotés de l’Internet des objets (IoT) peuvent collecter des données sur la température, l’humidité et les vibrations en temps réel, et les modèles d’IA analysent les écarts et les tendances de ces informations. En identifiant les modèles qui précèdent les non-conformités, l’entreprise peut agir avant qu’il n’y ait un impact sur le produit/service.
- Corrélation des données de marché avec le contexte épidémiologique – L’ intelligence artificielle peut intégrer des alertes internationales et des données locales issues d’épidémies ou de rappels pour ajuster les plans de production et d’inspection, et permet ainsi de hiérarchiser les lots critiques et de renforcer la traçabilité.
- Classification intelligente des risques par produit et par ligne de fabrication – Les modèles de machine learning peuvent classer et classer les produits, les processus et les installations industrielles en fonction de leur criticité, de leur forme pharmaceutique et de la complexité de leurs installations. Cela permet à l’équipe qualité de concentrer ses ressources et ses efforts d’inspection sur les zones les plus sensibles.

Quels sont les impacts pratiques de cette résolution du Conseil collégial ?
Comme vous pouvez l’imaginer, la norme RDC 982/2025 reflète plusieurs changements et adaptations pour les entreprises qui souhaitent maintenir/obtenir leurs certificats, ou simplement assurer une opération conforme aux meilleures pratiques sanitaires du marché.
Les principaux impacts de la résolution peuvent être divisés en trois catégories : opérationnels, financiers et réputationnels et commerciaux. Apprenez-en plus sur chacun d’entre eux ci-dessous !
Impact opérationnel
- Continuité des contrôles : Avec la mise en œuvre de la résolution 982/2025 du Collegiate Board, les entreprises disposeront d’indicateurs en temps réel (ou avec une cadence fréquente) qui montrent les performances de production, les écarts, les non-conformités et l’efficacité des CAPA.
- Intégration entre les domaines : Les secteurs de la réglementation, de la qualité, de la chaîne d’approvisionnement et de l’informatique commencent à travailler de manière intégrée pour démontrer un contrôle de bout en bout du respect de la résolution.
Impact financier
- Coûts d’adéquation : Il est nécessaire d’augmenter les investissements dans les systèmes de gestion de la qualité. Il peut être nécessaire de s’appuyer sur des solutions d’automatisation, des audits internes et des formations.
- Risque de perte de revenus : En cas de non-conformité, l’annulation d’un certificat ou la nécessité d’exigences correctives qui perturbent les opérations peuvent entraîner des pertes directes et des coûts de remédiation.
- Avantage pour le marché : D ‘autre part, les entreprises qui ont des preuves de gouvernance et de conformité continue ont tendance à réduire le temps consacré aux futurs processus réglementaires et à accéder potentiellement à des marchés qui valorisent cette conformité.
Réputation et impact commercial
- Exposition au marché : Toute mesure punitive (telle que des enquêtes ou la suspension des certificats) indiquée par la RDC 982/2025 en cas de non-conformité a un impact direct sur la confiance des partenaires, des clients et des investisseurs.
- Différenciation concurrentielle : opérer avec des mesures de conformité transparentes peut être un avantage dans les contrats avec des parties prenantes exigeantes en matière de sécurité sanitaire, ainsi que plusieurs acteurs sur le marché international.

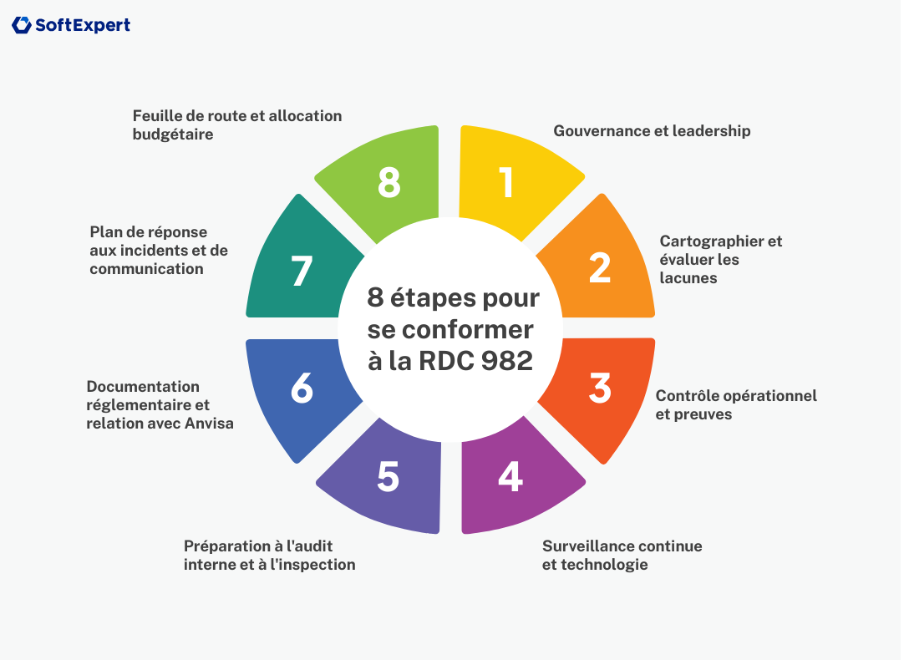
8 étapes pour que votre entreprise s’adapte au nouveau CDR
Pour éviter que les impacts négatifs de la résolution 982/2025 du Conseil collégial n’affectent votre entreprise, il est essentiel de savoir adapter votre fonctionnement et d’assurer le respect des principales exigences de la CDR. Cela signifie qu’il faut examiner les politiques internes, stipuler des contrôles continus, mettre en œuvre des changements de manière structurée, etc.
Afin de faciliter cette adaptation, nous avons préparé une brève liste de contrôle qui convient à la plupart des profils d’entreprises touchées par la nouvelle résolution. Mais n’oubliez pas : il ne s’agit que d’une structure standard, adaptez tout à la réalité de votre entreprise et utilisez l’information comme point de départ.
1. Gouvernance et leadership
- Nommer un chargé de projet principal pour l’adaptation à la RDC. Cette personne doit avoir l’autorité de diriger les ressources (financières, en temps, en personnel, entre autres.
- Créez un comité multidisciplinaire (impliquant des secteurs tels que la réglementation, la qualité, la chaîne d’approvisionnement, l’informatique, le juridique, entre autres) et organisez des réunions périodiques pour suivre les indicateurs clés de performance liés au projet – qui seront définis plus loin dans cette liste de contrôle.
2. Cartographier et évaluer les écarts
- Effectuer une analyse des écarts en tenant compte des 17 critères mentionnés dans le CDR. À ce stade, essayez de cartographier la présence ou l’absence de contrôles, de preuves documentaires, d’indicateurs, de risques résiduels et d’autres critères.
- Ensuite, priorisez l’ordre de résolution des écarts constatés en utilisant comme critère principal l’impact de chacun d’entre eux sur la conformité au CDR. Évaluez cet impact en tenant compte du niveau de risque (élevé, moyen, faible) par rapport à la facilité d’atténuation de chacun.
3. Contrôle opérationnel et éléments de preuve
- Consolidez toutes les preuves trouvées dans les processus précédents. Il peut s’agir de procédures, de registres de production, de rapports d’étalonnage, de traçabilité, de rapports d’écart et de CAPA.
- Mettre en place des indicateurs clés (KPI) qui serviront de base à l’évaluation du projet de conformité à la DRC. Par exemple, vous pouvez utiliser la fréquence des écarts critiques par lot, le temps de clôture moyen des CAPA, la température de stockage moyenne, le niveau de conformité, etc.
4. Surveillance continue et technologie
- Adoptez un système de gestion de la qualité numérique qui vous permet de collecter et d’interroger des preuves en temps réel. Privilégiez également les solutions qui ont des intégrations avec les systèmes de fabrication et de stockage (MES, WMS) ou qui ont déjà ces outils parmi leurs ressources.
- Mettez en place des tableaux de bord qui indiquent le niveau de conformité et des alertes automatiques pour les niveaux critiques de non-conformité.
5. Audit interne et préparation à l’inspection
- Planifiez un cycle d’ audits internes axé sur les 17 critères, à l’aide de listes de contrôle standardisées et d’autres outils qui augmentent les chances de succès d’un audit.
- Simulez des inspections et examinez les réponses et les preuves trouvées dans cette simulation.
6. Documentation réglementaire et relation avec l’Anvisa
- Examinez les pétitions et les dossiers en cours pour vérifier l’impact de la règle sur votre entreprise, en particulier dans les cas où aucune décision n’a été publiée au Journal officiel de l’Union (DOU).
- Établir un flux de communication avec le secteur technique/réglementaire pour envoyer des preuves proactives sur demande.
7. Plan d’intervention et de communication en cas d’incident
- Établissez un manuel de réponse pour ces occasions. N’oubliez pas d’inclure des actions visant à l’enquête, à l’atténuation, au signalement interne et à la communication externe (avec les clients et les autorités sanitaires, si nécessaire).
- Former les équipes pour garantir des délais d’exécution agiles et la qualité des preuves.
8. Feuille de route et allocation budgétaire
- Établissez un calendrier pour la planification et l’exécution de toutes les activités précédentes. Créez également des jalons/délais clairs pour chacun, tels que ce qui sera fait de 0 à 3 mois ; après 3 à 9 mois ; et enfin de 9 à 18 mois. Indiquez également qui seront les personnes responsables de chacune de ces étapes.
- Budget pour toutes les initiatives essentielles, y compris l’investissement dans les outils, les systèmes, les conseils réglementaires, le renforcement des capacités, etc.
La solution idéale pour les entreprises adaptée par la RDC 982/2025
Il ne suffit pas de s’adapter au nouveau CDR et d’avoir un cadre défini pour analyser les lacunes, planifier les actions et adapter vos opérations pour faciliter la conformité au nouveau CDR. Les entreprises qui souhaitent rendre ce processus plus agile, sécurisé et automatisé doivent aller plus loin : s’appuyer sur un système de management de la conformité et de la qualité tel que SoftExpert Suite.
Avec ce système, vous pouvez effectuer une série de tâches qui aident votre entreprise à se conformer à la réglementation Anvisa. Parmi eux , le suivi continu de la conformité, la traçabilité complète des processus, l’IA intégrée validée par les normes Anvisa, l’automatisation de la gestion des changements et des non-conformités, l’analyse prédictive des risques, et bien plus encore.
En savoir plus sur la façon dont SoftExpert Suite dispose déjà de fonctionnalités compatibles avec la norme RDC 982/2025.
Surveillance continue du respect de la résolution du Conseil collégial
SoftExpert QMS automatise et intègre les processus essentiels de gestion de la qualité, tels que la planification, les audits, le contrôle qualité, les non-conformités, les documents, les fournisseurs, les risques et les indicateurs. Cela permet de réduire les reprises, d’augmenter la normalisation et de renforcer la conformité.
Cela permet au système d’ identifier les tendances en matière de non-conformité avant qu’elles ne deviennent des problèmes pour votre entreprise. De plus, vous disposez d’alertes et de tableaux de bord en temps réel pour accélérer la prise de décision stratégique et atténuer les impacts négatifs.
C’est ainsi que l’entreprise Pharlab a automatisé la gestion des formations et des documents, réduisant ainsi les coûts de gestion de la qualité de 48 %.
Préparation automatique aux audits DRC
Grâce à la fonctionnalité d’audit, vous pouvez gérer efficacement vos audits, de la planification à la préparation et à l’exécution, en passant par l’établissement de calendriers, l’élaboration de plans et la publication de rapports.
Cela vous permet d’organiser automatiquement les preuves en fonction de chaque critère de la norme RDC 982/2025, ainsi que de générer des rapports structurés pour les auditeurs de l’Anvisa – et tout cela avec une traçabilité complète de chaque étape du processus d’audit.
Gestion intelligente du changement
Une série de ressources travaillent de manière intégrée pour assurer une gestion intelligente et automatisée des différents changements (et le contrôle de ces changements) que le nouveau CDR peut générer dans le fonctionnement de votre entreprise.
En combinant des outils tels que Workflow, Document et Training, il est possible de :
- Générer des flux automatisés qui assurent l’approbation/révision appropriée des documents ;
- Partager ces documents avec différentes zones/personnes et gérer l’accès à ceux-ci ;
- Rendre automatiquement disponible toutes les formations obligatoires liées au RDC 982.
De cette façon, l’entreprise pharmaceutique União Química a pu numériser plus de trois mille documents critiques, ce qui a généré une augmentation de 30 % de la productivité grâce à l’accès instantané aux informations contenues dans ces documents.
Analyse prédictive des risques
À l’aide de l’IA et de la fonctionnalité de risque de Copilot, vous utilisez la puissance d’analyse de l’intelligence artificielle avec la possibilité de documenter, de simuler et de corriger les risques de conformité.
Copilot AI identifie les modèles qui peuvent provoquer des non-conformités et, en outre, propose des recommandations automatiques d’actions préventives et correctives. À l’aide de l’outil Risque, vous pouvez simuler différents scénarios et ainsi prendre la bonne décision pour faire face à ces menaces.

Conclusion
La norme RDC 982/2025 représente une étape importante dans la manière dont l’Anvisa gère les risques sanitaires, en apportant plus de rigueur technique, de transparence et de prévisibilité au processus d’octroi et de renouvellement des certifications. En alignant les critères d’évaluation sur les pratiques internationales et en intégrant des ressources technologiques, la résolution renforce la nécessité pour les entreprises d’adopter des systèmes de gestion de la conformité robustes, capables de répondre rapidement à des exigences réglementaires de plus en plus dynamiques.
Pour les fabricants, les importateurs et les distributeurs d’IPA, de médicaments, de produits biologiques, de dispositifs médicaux et de dérivés du cannabis médical, la conformité à ces exigences va au-delà de la conformité légale. La nouvelle norme est un mécanisme visant à maintenir la compétitivité, à protéger la réputation et à assurer la continuité des activités dans un marché hautement réglementé. Par conséquent, anticiper les changements et investir dans des processus d’amélioration continue sera essentiel pour transformer les obligations de la RDC 982/2025 en un avantage stratégique.
Si votre organisation utilise ces produits, c’est le moment de :
- Entamer une analyse des écarts axée sur les 17 critères de la résolution ;
- Prioriser la mise en place d’un suivi continu avec des indicateurs actionnables ;
- Mobiliser la haute direction pour assurer les ressources et la gouvernance nécessaires.
Vous cherchez plus d’efficacité et de conformité dans vos opérations ? Nos spécialistes peuvent vous aider à identifier les meilleures stratégies pour votre entreprise avec les solutions de SoftExpert. Contactez-nous dès aujourd’hui !!
FAQ sur le règlement RDC 982/2025
Oui, la résolution est entrée en vigueur à la date de sa publication au Journal officiel. Les entreprises devraient tenir compte de la règle pour les poursuites qui n’ont pas encore été publiées.
Comme la CDR est en vigueur depuis le 29 juillet 2025, l’adaptation doit être immédiate pour les nouveaux processus.
Cherchez à utiliser des API robustes qui permettent l’intégration avec les ERP et les systèmes existants sans interruption.
Les API, les médicaments, les produits à base de cannabis médical, les produits biologiques et les dispositifs médicaux sont explicitement énumérés dans le champ d’application.
Les distributeurs et les entreposeurs sont désormais évalués par le même cadre de gestion des risques. De plus, les preuves de contrôle de la qualité et de traçabilité deviennent pertinentes pour le maintien de la CBPDA.
Oui, la norme prévoit une surveillance continue et qu’un avis technique fondé sur la gestion des risques peut donner lieu à des mesures administratives, y compris la suspension ou l’annulation des certificats lorsqu’il existe des risques pertinents.
Parmi les preuves requises, citons l’historique complet de la conformité, les données de surveillance continue et les analyses de risques documentées.
Grâce à un système de gestion de la qualité intégré, à des indicateurs clés de conformité, à des audits internes réguliers, à des enregistrements électroniques vérifiables et à la capacité de réagir rapidement aux écarts et aux enquêtes.
Les certifications actuelles restent valables, mais font l’objet d’un contrôle continu et d’une éventuelle annulation sur la base d’une analyse des risques.
Parmi les principaux figurent la perte de certifications, les amendes, l’interruption des opérations et la perte de compétitivité.
Pour le savoir, évaluez si votre outil d’IA répond aux normes de cohérence, de protection des données, de traçabilité et de validation technique requises par Anvisa.




